한국아스텔라스제약 베타미가서방정 25mg(미라베그론 25mg) 효능과 주의사항(부작용) 확인
안녕하세요.
이번 포스팅에서는 한국아스텔라스제약 베타미가서방정 25mg(미라베그론 25mg)의 효능과 용법·용량, 주의사항 등에 대해 확인해보겠습니다.
항상 약을 먹더라도 이 약이 어떤 효과가 있고 부작용에는 어떤 것들이 있는지 확인하는 습관을 들이는 것이 중요합니다.
그럼 한국아스텔라스제약 베타미가서방정 25mg(미라베그론 25mg)에 대해 확인해보겠습니다.
상세 정보
[식약처 분류] - 기타의 비뇨생식기관 및 항문용약으로 구분됩니다.
[제조 / 수입사] - 한국아스텔라스제약에서 제조하여 판매 중에 있습니다.

효능과 용법_베타미가서방정 25mg(미라베그론 25mg)
[효능·효과]
성인: 과민성 방광 환자에서 발생할 수 있는 절박뇨, 빈뇨 및 절박요실금 증상의 치료
[용법·용량]
성인 (노인 환자 포함) 에서는 권장용량으로서 1회 50mg을 1일 1회 경구 투여한다.
이 약은 음식과 함께 또는 음식과 상관없이 투여할 수 있으며, 물과 함께 삼켜야 하며 씹거나 부수어서는 안 된다.
다음은 신장애 및 간장애 환자에 대한 강력한 CYP3A 저해제 유무 하에서의 일일권장용량 표이다 (‘사용상의 주의사항 5)상호작용’ 참조)
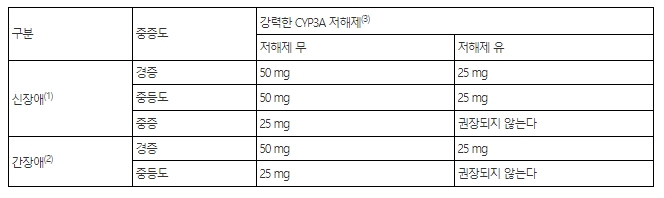
(1) 경증: GFR 60~89 mL/min/1.73m2;중등도: GFR 30~59 mL/min/1.73m2;중증: GFR 15~29 mL/min/1.73m2.
(2) 경증: Child-Pugh Class A; 중등도: Child-Pugh Class B.
(3) 강력한 CYP3A 저해제는 ‘5) 상호작용’ 참조
사용상의 주의사항_베타미가서방정 25mg(미라베그론 25mg)
1. 다음의 환자에는 투여하지 말 것
1) 이 약의 주성분 또는 다른 성분에 과민증이 있는 환자
2) 중증의 조절되지 않는 고혈압 환자 (수축기 혈압 ≥180mmHg 및/또는 이완기 혈압 ≥110mmHg)
3) 심각한 심장질환 환자(혈압 상승 등의 사례가 보고되었기 때문에 증상이 악화될 수 있다.)
2. 다음의 환자에는 신중히 투여할 것
1) 선천성 또는 후천성 QT 연장 환자 (‘4)일반적 주의’ 참조)
이 약은 치료용량 하에서, 임상시험 결과 QT 연장과 임상적 관련성이 없는 것으로 밝혀졌다. 하지만 임상시험에 QT 연장 병력이 있거나 QT 연장 가능한 약물을 복용 중인 환자가 포함되지 않았으므로, 이러한 환자들에 대한 이 약의 효과는 알려진 바가 없고, 따라서 이 약을 투여 시 주의를 기울여야 한다.
2) 이 약은 아래 환자군에 대해서는 연구되지 않았으므로 투여가 권장되지 않는다.
- 말기 신장 질환 환자 (GFR <15mL/min/1.73m2또는 혈액투석을 요하는 환자)
- 중증의 간장애 환자 (Child-Pugh class C)
3) 이 약은 효소 저해제와 상호작용이 있으므로 아래 환자군에서는 투여가 권장되지 않는다.
- 강력한 CYP3A4 저해제를 병용투여중인 중증의 신장애 환자 (GFR 15∼29mL/min/1.73m2)
- 강력한 CYP3A4 저해제를 병용투여중인 중등도의 간장애 환자 (Child-Pugh class B)
4) 방광출구폐쇄 환자 및 과민성방광 치료를 위해 항무스카린 제제를 복용중인 환자 (‘4. 일반적주의’ 참조)
3. 이상반응
1) 외국임상시험에서 보고된 이상반응
8433명의 과민성방광 환자들이 임상시험에서 이 약을 투여받았다. 이 중 5648명은 2/3상 임상시험에서 적어도 1회 이 약을 복용했고, 622명의 환자들은 적어도 1년(365일) 이상 이 약을 복용했다.
3 개의 12주 3상 이중 눈가림 위약 대조 시험들에서 환자 중 88%가 이 약 투여를 완료했고, 환자 중 4%는 유해사례 때문에 중단했다. 대부분의 이상반응들은 그 중증도가 경증에서 중등도였다.
3 개의 12주 3상 이중 눈가림, 위약 대조 시험 도중 이 약 50mg을 투여 받은 환자들에서 보고된 가장 흔한 이상반응은 빈맥(1.2%)과 요로감염(2.9%)이었다. 빈맥은 이 약 50mg 투여 환자 중 0.1%에서 투여중단을 유발했다. 요로감염은 이 약 50mg 투여 환자들에서 투여중단을 유발하지 않았다. 중대한 이상반응은 심방세동(0.2%)을 포함한다.
1년 (장기) 활성대조약(무스카린 길항제) 대조 시험에서 관찰된 이상반응들은 3 개의 12주 3상 이중 눈가림, 위약 대조 시험에서 관찰된 것들과 유형 및 중증도에서 유사했다.
아래 표는 3 개의 12주 3상 이중 눈가림, 위약 대조 임상시험들에서 관찰된 이상반응들을 제시한다.
[표1] 3 개의 12주 3상 이중 눈가림, 위약 대조 시험들에서 관찰된 이상반응



9. 기타
1) 비임상 시험에서 독성 표적 장기를 확인했는데, 임상적 관찰과 일치한다. 간 효소에서의 일시적 상승과 간세포 변화(괴사 및 글리코겐입자의 감소)가 랫트에서 관찰되었다. 심박동수의 증가가 랫트, 토끼, 개, 그리고 원숭이에서 관찰되었다. In vivo에서 유전독성 및 발암성 시험들은 유전독성 또는 발암성 잠재성이 없음을 보였다.
2) 수태능에 대한 효과는 아-치사량(사람 동등 용량은 MHRD(사람 최대권장용량) 보다 19배 높다)에서 보여지지 않았다. 토끼 태아 발달시험에서의 주요 관찰은 MHRD 관찰 시 보다 36배 높은 전신노출 에서 심장 기형(대동맥확장, 심장비대증)을 포함한다. 추가적으로 토끼에서 MHRD 관찰 시 보다 14배 높은 전신노출에서 폐 기형(폐 부폐엽 부재)과 착상 후 유산이 관찰되었고, MHRD 관찰 시 보다 22배 높은 전신노출에서는 골화에 대한 가역적인 효과(물결갈비, 지연골화, 골화한 흉골추 장골, 중족골 수의 감소)가 보고되었다. 관찰된 배 태자 독성은 모체독성과 관련된 용량에서 나타났다. 토끼에서 관찰된 심장기형은 베타 1 아드레날린수용체의 활성화를 통해 매개되는 것으로 보인다.
3) 방사능-표지된 이 약으로 수행된 약물동태시험에서 모화합물 및/또는 그 대사체들이 투여 4시간 후 혈장농도보다 1.7배 높은 농도로 랫트의 유즙으로 분비되었다.
복약정보_베타미가서방정 25mg(미라베그론 25mg)

끝으로..
지금까지 한국아스텔라스제약 베타미가서방정 25mg(미라베그론 25mg) 효능과 주의사항에 대해 확인해봤습니다.
미래의 의사는 환자에게 약을 주기보다 환자가 자신의 체질과 음식, 질병의 원인과 예방에 관심을 갖도록 할 것이라고 토마스 A. 에디슨은 말했습니다.
아직은 에디슨이 말한 미래가 오지 않은 것 같습니다.
우리 스스로 아프지 않도록 몸 관리를 잘해야 하며 의사에 의존하지 않고 스스로 약의 성분도 확인하는 사람이 될 수 있도록 노력합시다.
오늘도 감사합니다.
'의약품 정보' 카테고리의 다른 글
| 한국콜마 파리에트정 10mg(라베프라졸나트륨 10mg) 효능과 주의사항(부작용) 확인 (0) | 2020.12.10 |
|---|---|
| 영진약품 덱사코티실정(덱사메타손 0.75mg) 효능과 주의사항(부작용) 확인 (0) | 2020.12.10 |
| 보령제약 보령메이액트정 100mg(세프디토렌피복실 100mg) 효능과 주의사항(부작용) 확인 (0) | 2020.12.09 |




댓글